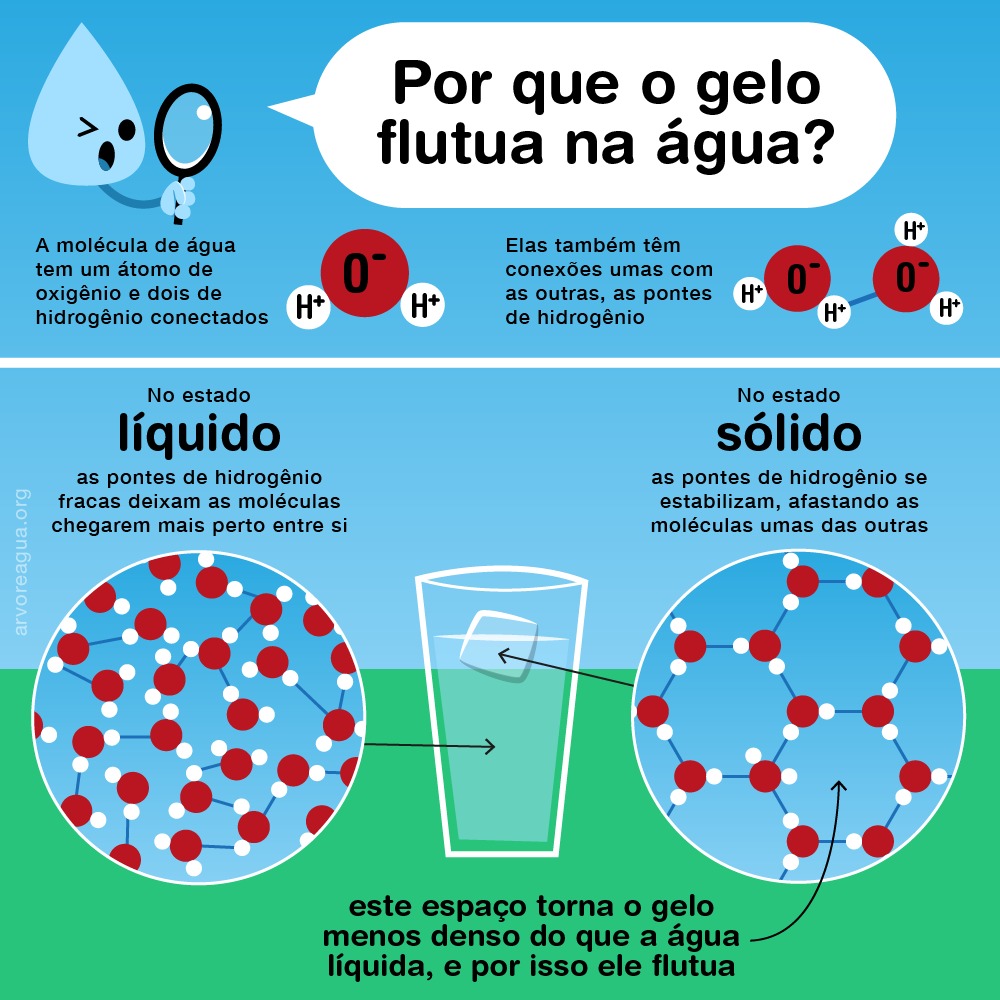
Já parou para pensar por que os icebergs não afundam no oceano? Geralmente, elementos no estado sólido são mais densos e afundam. Por que isso não acontece com o gelo? Eis mais uma particularidade da água! No estado líquido, todas as moléculas são mantidas juntas e livres para se mover. Quando a água atinge o estado sólido (gelo), as moléculas se organizam de tal maneira que os átomos de oxigênio se afastam uns dos outros, mantendo uma posição fixa com uma certa distância entre elas e formando uma estrutura cristalina tridimensional. Isso acontece graças à organização das ligações de hidrogênio, que cria cavidades em uma estrutura hexagonal. Por causa dos espaços vazios, o gelo fica com uma densidade menor e flutua!
Mais uma curiosidade: por esse mesmo motivo, a água congelada ocupa um volume maior em comparação com a água em estado líquido. Quem já colocou uma garrafa com água no freezer e encontrou a garrafa quebrada depois de um tempo? Isso acontece porque a expansão resultante do rearranjo das moléculas de água exerce pressão sobre as paredes de vidro. Por isso, ao congelar água em garrafas de vidro, é preciso deixar espaço para a expansão do volume.
Saiba mais: Densidade da água e do gelo – Mundo Educação: http://bit.ly/37JoOUv
